QUÍMICA II
PROPÓSITO DE LA ASIGNATURA:QUE EL ESTUDIANTE SE CAPAZ DE IDENTIFICAR LO ELEMENTOS QUÍMICOS TANTO EN LA TABLA PERIÓDICA COMO FÍSICOS APRENDER A UTILIZAR RESPECTIVAMENTE LAS FORMULAS NECESARIAS PARA PODER CREAR LOS DISTINTOS MODELOS ATÓMICOS ENTRE OTRAS COSAS
RELACION CON OTRAS ASIGNAURAS: LA QUIMICA SE VA DE LA MANO PRINCIPALMENTE CON LA FISICA YA QUE ES LA MATERIA MAS ASOCIADA A LA QUIMICA CON SS RESPECTIVOS PROBLEMAS ADEMAS TTENDRAS QUE
Realizará cálculos estequiométricos. Identificará las diversas formas de expresar las unidades de concentración química, mediante la preparación de disoluciones acuosas, sólidas y gaseosas. Distinguirá las diferencias entre las propiedades de los compuestos orgánicos, su estructura características y nomenclatura. Comprenderá la importancia de la química orgánica en su vida diaria, así como sus contribuciones al desarrollo humano y científico. Identificará el impacto del uso de los compuestos inorgánicos en: la salud, alimentación, naturaleza y el ámbito industrial.
Competencias propuestas para desarrollar en el estudiante para la materia de QUIMICA II
:
Construye hipótesis y diseña y aplica modelos para probar su validez. Sintetiza evidencias obtenidas mediante la experimentación para producir conclusiones y formular nuevas preguntas. Utiliza las tecnologías de la información y comunicación para procesar e interpretar información. Sustenta una postura personal sobre temas de interés y relevancia general, considerando otros puntos de vista de manera crítica y reflexiva.
Elige las fuentes de información más relevantes para un propósito específico y discrimina entre ellas de acuerdo a su
relevancia y confiabilidad. Evalúa argumentos y opiniones e identifica prejuicios y falacias. Reconoce los propios prejuicios, modifica sus puntos de vista al conocer nuevas evidencias, e integra nuevos conocimientos
y perspectivas al acervo con el que cuenta. Estructura ideas y argumentos de manera clara, coherente y sintética. . Aprende por iniciativa e interés propio a lo largo de la vida.
Define metas y da seguimiento a sus procesos de construcción de conocimiento. Identifica las actividades que le resultan de menor y mayor interés y dificultad, reconociendo y controlando sus
reacciones frente a retos y obstáculos. Articula saberes de diversos campos y establece relaciones entre ellos y su vida cotidiana. . Participa y colabora de manera efectiva en equipos diversos.
Propone maneras de solucionar un problema o desarrollar un proyecto en equipo, definiendo un curso de acción con
pasos específicos. Aporta puntos de vista con apertura y considera los de otras personas de manera reflexiva. Asume una actitud constructiva, congruente con los conocimientos y habilidades con los que cuenta dentro de distintos
equipos de trabajo. . Participa con una conciencia cívica y ética en la vida de su comunidad, región, México y el mundo.
Privilegia el diálogo como mecanismo para la solución de conflictos. Toma decisiones a fin de contribuir a la equidad, bienestar y desarrollo democrático de la sociedad. Contribuye a alcanzar un equilibrio entre el interés y bienestar individual y el interés general de la sociedad. Actúa de manera propositiva frente a fenómenos de la sociedad y se mantiene informado. Advierte que los fenómenos que se desarrollan en los ámbitos local, nacional e internacional ocurren dentro de un
contexto global interdependiente. 11. Contribuye al desarrollo sustentable de manera crítica, con acciones responsables.
Asume una actitud que favorece la solución de problemas ambientales en los ámbitos local, nacional e internacional Reconoce y comprende las implicaciones biológicas, económicas, políticas y sociales del daño ambiental en un contexto
global interdependiente. Contribuye al alcance de un equilibrio entre los intereses de corto y largo plazo con relación al ambiente
Estructura conceptual de la materia de QUIMICA II :
HISTORIA DE LA QUÍMICA INORGÁNICA
Historia
Antiguamente se definía como la química de la materia inorgánica, pero quedó obsoleta al desecharse la hipótesis de la fuerza vital, característica que se suponía propia de la materia viva que no podía ser creada y permitía la creación de las moléculas orgánicas.Se suele clasificar los compuestos inorgánicos según su función en ácidos, bases, óxidos y sales, y los óxidos se les suele dividir en óxidos metálicos (óxidos básicos o anhídridos básicos) y óxidos no metálicos (óxidos ácidos o anhídridos ácidos).
Al ver una fórmula, generalmente lo podemos ubicar en uno de estos grupos.
Ácidos cuando observamos el símbolo del hidrógeno al extremo izquierdo de la fórmula, como HCl (ácido clorhídrico).
Bases cuando observamos un metal al principio de la fórmula unido al anión hidróxilo (OH-) al final, como NaOH (hidróxido de sodio).
Óxidos a los compuestos BINARIOS del oxígeno, (ojo, debe ser binario contener sólo dos elementos en la fórmula, uno de ellos es el oxígeno que va escrito su símbolo al extremo derecho. Óxido metálico cuando es un metal el que se enlaza al oxígeno ( óxidos metálicos binarios), como Fe2O3 (óxido férrico). Óxido no metálico cuando es un no-metal el enlazado al oxígeno, como CO ( monóxido de carbono).
Sales son aquellas que están formadas por un metal y un anión que no es ni óxido ni hidróxido, como el NaCl (cloruro sódico)
Como excepción está que el ion amonio (NH4+) puede hacer la función de un metal en las sales, y también se encuentra en las disoluciones de amoníaco en agua, ya que no existe el compuesto hidróxido amonico, NH4OH, ni ha sido detectado en ningún sistema mediante condiciones especiales.

Campo de trabajo
El nombre tiene su origen en la época en la que todos los compuestos del carbono se obtenían de seres vivos; de ahí la química del carbono se denomina química orgánica. La química de compuestos sin carbono, fue, por ende, llamada química inorgánica.
Actualmente, se obtienen compuestos orgánicos en el laboratorio, de forma que la separación es artificial. Algunas de las sustancias con carbono que entran en el campo de la química inorgánica incluyen:
grafito, diamante (fulereno y nanotubos se consideran más bien orgánicos)
carbonatos y bicarbonatos
carburo
Tabla de elementos químicos
Apartados de interés de la química inorgánica incluyen:
La tabla periódica de los elementos:
Elementos representativos
Metales de transición
Química de las tierras raras
Química de coordinación
Química de los compuestos con enlace metal-metal
Áreas relacionadas
Áreas de solapamiento con otros campos del conocimiento incluyen:
Ciencia de materiales
Geoquímica
Magnetoquímica
Mineralogía
Química analítica
Química bioinorgánica
Química del estado sólido
Química física
Química medioambiental
Química organometálica
Véase también
IUPAC
Nomenclatura
Nomenclatura química de los compuestos inorgánicos
Nomenclatura de sustancias orgánicas
Fuentes
Química inorgánica

PROGRAMA PARA LA ASIGNATURA DE QUIMICA 2
-MATERIA Y ENERGIA
-balance de materia y energia
-estados fisicos de la materia
-transformaciones en el mundo material (energia)
-LEY DE LA CONSERVCACION DE LA MASA
-ley de la conmservacion de la materia
-estequiometria
-estructura molecular
-LEY DE LAS PROPORCIONES DEFINIDAS
-definicion de la ley
-leyes que fundamentaron la quimica
-aplicaciones de la ley
- DETERMINACIÓN DE MASAS MOLECULAR RELATIVA
-hipotesis de avogadro
-isotopos
-masa atomica relativa
-NUMERO DE AVOGADRO (MOL)
-constante de avogadro
-carga eléctrica y carga elemental
-Método de la densidad del cristal por rayos X
MATERIA Y ENERGÍA
¿A qué se llama materia?
Se llama materia a todo aquello que tiene dimensiones, presenta inercia y origina gravitación. Veamos con más detalle estas propiedades básicas de la materia:
Dimensiones: ocupa un lugar en el espacio
Inercia: resistencia que opone la materia a modificar su estado de reposo o de movimiento.

Gravedad o gravitación: es la atracción que actúa siempre entre objetos materiales aunque estén separados por grandes distancias. La gravedad por ejemplo es la responsable de que los objetos caigan al suelo y no se queden suspendidos flotando.

Errores frecuentes en relación con el concepto de masa:
¿Los cuerpos más grandes tiene siempre más masa? No hay relación directa entre el tamaño y la masa, ya que la masa de un cuerpo puede estar mas o menos compactada y ocupar más o menos volumen. La relación entre la masa de un cuerpo y su volumen (tamaño) viene determinada por la densidad.

¿Es lo mismo masa que peso? No es lo mismo, la masa de un cuerpo mide su inercia, mientras que el peso mide la fuerza con la que el objeto es atraído por la Tierra.
BALANCE DE MATERIA Y ENERGÍA
[Balances de Materia y Energía], junto con numerosos ejemplos de aplicación a diferentes operaciones y procesos. A continuación se repasan las ideas básicas para el planteamiento de los BM, y se indican posibles estrategias para su utilización en el PFC.
Los BM se basan en la ley de conservación de la materia, la cual, rigurosamente hablando, hay que aplicarla al conjunto materia-energía, y no a la materia o energía por separado. Sin embargo, en las condiciones que se dan en los procesos industriales objeto de los PFC en la UGR, al no abordarse el caso de los reactores nucleares, no existe transformación de materia en energía o viceversa, con lo que la forma general del balance de materia TOTAL a un sistema, será:

La forma del balance a cada uno de los componentes será la misma, excepto cuando existe reacción química, ya que en ese caso habrá que considerar la aparición o desaparición de los componentes individuales por efecto de la reacción (sin embargo la masa total del sistema nunca variará). Por ello el BM al componente ‘i’ tendrá la forma:

Una situación muy frecuente es que el proceso sea continuo, con lo cual el término de acumulación será 0.
Tal y como se ha indicado los BM se pueden aplicar a una unidad de proceso (un equipo), como a todo el proceso completo. Para una unidad o equipo, podrán plantearse tantos BM independientes como componentes intervienen en el mismo, y a un proceso completo se le podrán plantear un número de BM independientes igual a la suma de los de todas las unidades del mismo, entendiendo como unidades de un proceso los equipos u operaciones que lo integran. Además, en algunos casos existen relaciones impuestas entre las distintas corrientes que nos pueden servir como ecuaciones adicionales a los BM.
BALANCE DE ENERGIA
Los BE son normalmente algo más complejos que los de materia, debido a que la energía puede transformarse de unas formas a otras (mecánica, térmica, química, etc.), lo que obliga a considerar este aspecto en las ecuaciones. En general, en el PFC, los BE serán imprescindibles en equipos en los que el intercambio de energía sea determinante, lo que fundamentalmente sucederá en cambiadores de calor, evaporadores, columnas de destilación, etc., es decir, cuando haya que calentar o enfriar un fluido. En el caso de los reactores químicos, también son imprescindibles los balances de energía para su diseño, ya que en cualquier caso habrá que asegurarse de que la temperatura del reactor permanezca dentro del intervalo deseado, especialmente cuando los efectos térmicos de la reacción sean importantes. En reacciones bioquímicas dichos efectos no suelen ser muy significativos, así que se podrán ignorar en el dimensionamiento preliminar de los fermentadores o reactores enzimáticos, siempre que se justifique.
Dejando de lado el planteamiento de los BE en reactores, en la mayoría de los otros equipos, y a efectos de dimensionamiento preliminar, la llamada ecuación de las entalpías, que se incluye a continuación, suele ser suficiente para su planteamiento.

Donde ms y me son los caudales másicos de entrada y salida del sistema, He y Hs las entalpías de los mismos, y Q el calor intercambiado por el sistema, que si es positivo será ganado por el sistema, y si es negativo será cedido por el mismo a los alrededores. El cálculo de la entalpía de cada corriente puede realizarse usando de su capacidad calorífica, y una temperatura de referencia, aunque si hay cambios de fase también habrá que considerar el calor latente. Para el vapor de agua lo ideal es usar las tablas de vapor de agua saturado o recalentado, disponibles en bibliografía o incluso en aplicaciones on-line.
TRANSFORMACIONES EN EL MUNDO MATERIAL
1.4. Transformaciones en el mundo de material: la energía
Para que un cuerpo o sistema material sufra transformaciones, tiene que interaccionar con otro.
El calor transferido entre los cuerpos o sistemas materiales a distinta temperatura es un agente físico capaz de producir transformaciones en la materia.
Se realiza trabajos sobre un cuerpo cuando éste se desplaza bajo la acción de la fuerza que actúa total o parcialmente en la dirección del movimiento.
El calor y el trabajo son los agentes físicos que producen las informaciones de la materia.
Una transformación es cualquier cambio de las propiedades iniciales de un cuerpo o sistema material.
La alergia es la capacidad que tienen los cuerpos o sistemas materiales de transferir calor o de realizar un trabajo, de modo que, a medida que un cuerpo o un sistema transfiere calor o realiza un trabajo, su energía disminuye. La energía se miden en unidades sistema internacional (SI) llamada Julio (J.). El calor y el trabajo también se miden en estas unidades.
LEY DE LA CONSERVACION DE LA MASA
LEY DE LA CONSERVACIÓN DE LA MATERIA
La ley de conservación de la masa, ley de conservación de la materia o ley de Lomonósov-Lavoisier es una de las leyes fundamentales en todas las ciencias naturales. Fue elaborada independientemente por Mijaíl Lomonósov en 1745 y por Antoine Lavoisier en 1785. Se puede enunciar como «En una reacción química ordinaria, la masa permanece constante, es decir, la masa consumida de los reactivos es igual a la masa obtenida de los productos».1 Una salvedad que hay que tener en cuenta es la existencia de las reacciones nucleares, en las que la masa sí se modifica de forma sutil, en estos casos en la suma de masas hay que tener en cuenta la equivalencia entre masa y energía. Esta ley es fundamental para una adecuada comprensión de la química.
Los ensayos preliminares hechos por Robert Boyle en 1673 parecían indicar lo contrario: pesada meticulosa de varios metales antes y después de su oxidación mostraba un notable aumento de peso. Estos experimentos, por supuesto, se llevaban a cabo en recipientes abiertos.2
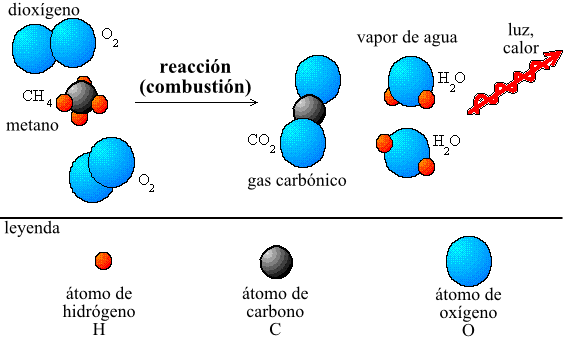
ESTEQUIOMETRIA
En química, la estequiometría (del griego στοιχειον, stoicheion, 'elemento' y μετρον, métrón, 'medida') es el cálculo de las relaciones cuantitativas entre losreactivos y productos en el transcurso de una reacción química.1 Estas relaciones se pueden deducir a partir de la teoría atómica, aunque históricamente se enunciaron sin hacer referencia a la composición de la materia, según distintas leyes y principios.
A escala microscópica una reacción química se produce por la colisión de las partículas que intervienen ya sean moléculas, átomos o iones, aunque puede producirse también por el choque de algunos átomos o moléculas con otros tipos de partículas, tales como electrones o fotones. Este choque provoca que las uniones que existían previamente entre los átomos se rompan y se facilite que se formen nuevas uniones. Es decir que, a escala atómica, es un reordenamiento de los enlaces entre los átomos que intervienen. Este reordenamiento se produce por desplazamientos de electrones: unos enlaces se rompen y otros se forman, sin embargo los átomos implicados no desaparecen, ni se crean nuevos átomos. Esto es lo que se conoce como ley de conservación de la masa, e implica los dos principios siguientes:
El número total de átomos antes y después de la reacción química no cambia.
El número de átomos de cada tipo es igual antes y después de la reacción.
En el transcurso de las reacciones químicas las partículas subatómicas tampoco desaparecen, el número total de protones, neutrones y electrones permanece constante. Y como los protones tienen carga positiva y los electrones tienen carga negativa, la suma total de cargas no se modifica. Esto es especialmente importante tenerlo en cuenta para el caso de los electrones, ya que es posible que durante el transcurso de una reacción química salten de un átomo a otro o de una molécula a otra, pero el número total de electrones permanece constante. Esto que es una consecuencia natural de la ley de conservación de la masa se denomina ley de conservación de la carga e implica que:
La suma total de cargas antes y después de la reacción química permanece constante.
Las relaciones entre las cantidades de reactivos consumidos y productos formados dependen directamente de estas leyes de conservación, y por lo tanto pueden ser determinadas por una ecuación (igualdad matemática) que las describa. A esta igualdad se le llama ecuación estequiométrica.
na ecuación química es una representación escrita de una reacción química. Se basa en el uso de símbolos químicos que identifican a los átomos que intervienen y como se encuentran agrupados antes y después de la reacción. Cada grupo de átomos se encuentra separado por símbolos (+) y representa a lasmoléculas que participan, cuenta además con una serie de números que indican la cantidad de átomos de cada tipo que las forman y la cantidad de moléculas que intervienen, y con una flecha que indica la situación inicial y la final de la reacción. Así por ejemplo en la reacción:

Tenemos los grupos de átomos (moléculas) siguientes:
O2
H2
H2O
ESTRUCTURA MOLECULAR
La geometría molecular o estructura molecular se refiere a la disposición tridimensional de los átomos que constituyen una molécula. Determina muchas de las propiedades de las moléculas,reactividad, polaridad, fase, color, magnetismo,actividad biológica, etc. Actualmente, el principal modelo Teoría de Repulsión de Pares de Electrones de Valencia (TRPEV), empleada internacionalmente por su gran predictibilidad
Un tercer tipo de movimiento es la vibración, un movimiento interno de los átomos en una molécula. Las vibraciones moleculares son armónicas (al menos en una primera aproximación), lo que significa que los átomos oscilan en torno a su posición de equilibrio, incluso a la temperatura del cero absoluto. En el cero absoluto todos los átomos están en su estado vibracional basal y muestran movimiento mecánico cuántico de punto cero, esto es, la función de onda de un modo vibracional simple no es un pico agudo, sino un exponencial de ancho finito. A temperaturas mayores, los modos vibracionales pueden ser excitados térmicamente (en un interpretación clásica, esto se expresa al enunciar que "las moléculas vibrarán más rápido"), pero siempre oscilan alrededor de una geometría reconocible para la molécula.
Para tener una comprensión más clara de la probabilidad de que la vibración de una molécula pueda ser térmicamente excitada, se inspecciona el factor de Boltzmann 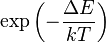 , donde
, donde 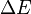 es la energía de excitación del modo vibracional,
es la energía de excitación del modo vibracional, 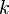 es la constante de Boltzmann y
es la constante de Boltzmann y  es la temperatura absoluta. A 298K (25 °C), unos valores típicos del factor de Boltzmann son: ΔE = 500 cm-1 --> 0.089; ΔE = 1000 cm-1 --> 0.008; ΔE = 1500 cm-1 --> 7 10-4. Esto es, si la energía de excitación es 500 cm-1, aproximadamente el 9% de las moléculas están térmicamente excitadas a temperatura ambiente. La menor energía vibracional de excitación es el modo de flexión (aproximadamente 1600 cm-1). En consecuencia, a temperatura ambiente menos del 0,07% de todas las moléculas de una cantidad dada de agua vibrarán más rápido que en el cero absoluto.
es la temperatura absoluta. A 298K (25 °C), unos valores típicos del factor de Boltzmann son: ΔE = 500 cm-1 --> 0.089; ΔE = 1000 cm-1 --> 0.008; ΔE = 1500 cm-1 --> 7 10-4. Esto es, si la energía de excitación es 500 cm-1, aproximadamente el 9% de las moléculas están térmicamente excitadas a temperatura ambiente. La menor energía vibracional de excitación es el modo de flexión (aproximadamente 1600 cm-1). En consecuencia, a temperatura ambiente menos del 0,07% de todas las moléculas de una cantidad dada de agua vibrarán más rápido que en el cero absoluto.
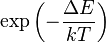 , donde
, donde 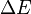 es la energía de excitación del modo vibracional,
es la energía de excitación del modo vibracional, 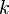 es la constante de Boltzmann y
es la constante de Boltzmann y  es la temperatura absoluta. A 298K (25 °C), unos valores típicos del factor de Boltzmann son: ΔE = 500 cm-1 --> 0.089; ΔE = 1000 cm-1 --> 0.008; ΔE = 1500 cm-1 --> 7 10-4. Esto es, si la energía de excitación es 500 cm-1, aproximadamente el 9% de las moléculas están térmicamente excitadas a temperatura ambiente. La menor energía vibracional de excitación es el modo de flexión (aproximadamente 1600 cm-1). En consecuencia, a temperatura ambiente menos del 0,07% de todas las moléculas de una cantidad dada de agua vibrarán más rápido que en el cero absoluto.
es la temperatura absoluta. A 298K (25 °C), unos valores típicos del factor de Boltzmann son: ΔE = 500 cm-1 --> 0.089; ΔE = 1000 cm-1 --> 0.008; ΔE = 1500 cm-1 --> 7 10-4. Esto es, si la energía de excitación es 500 cm-1, aproximadamente el 9% de las moléculas están térmicamente excitadas a temperatura ambiente. La menor energía vibracional de excitación es el modo de flexión (aproximadamente 1600 cm-1). En consecuencia, a temperatura ambiente menos del 0,07% de todas las moléculas de una cantidad dada de agua vibrarán más rápido que en el cero absoluto.Ley de las proporciones definidas o de Proust.

La ley de las proporciones definidas o la Ley de Proust enuncia:
Cuando se combinan dos o más elementos para dar un compuesto determinado, siempre lo hacen en la misma proporción fija, con independencia de su estado físico y de la manera de obtenerlo.
Consecuencias de la ley de Proust:
1º La constitución, por ejemplo, del cloruro sódico indica que para formar 5 g de cloruro sódico, se necesitan 3 g de cloro y 2 g de sodio, por lo que la proporción entre las masas de ambos elementos es:

2º Sin embargo, si hacemos reaccionar ahora 10 g de cloro con otros 10 g de sodio, no obtendremos 20 g de cloruro sódico, sino una cantidad menor, debido a que la relación de combinación entre ambas masas siempre es 1,5 por lo que:

3º Si ahora quisiéramos hallar la proporción entre los átomos que se combinan de cloro y sodio para formar cloruro sódico, deberíamos dividir la cantidad de cada elemento entre su masa atómica, de forma que si reaccionan 6 g de Cl con 4 g de Na, como 35,5 g/mol y 23 g/mol son las masas atómicas del cloro y sodio, respectivamente, entonces:

Lo que indica que por cada 0,17 moles de cloro reaccionan otros 0,17 moles de sodio para formar el cloruro sódico, o cualquier múltiplo o submúltiplo de esa reacción. Por tanto, 1 átomo de cloro también se combina con 1 átomo de sodio para formar cloruro sódico, luego la fórmula de éste compuesto es NaCl y la proporción entre sus átomos es
DEFINICIÓN DE LA LEY
Ley de las proporciones constantes
La ley de las proporciones constantes o ley de las proporciones definidas es una de las leyes estequiométricas enunciada en el año de 1799, según la cual cuando se combinan dos o más elementos para dar un determinado compuesto, siempre lo hacen en una relación constante de masas. Fue enunciada por el farmacéutico y químico francés Louis Proust, basándose en experimentos que llevó a cabo a principios del siglo XIX; por lo tanto, también se conoce como la ley de Proust.
Para los compuestos que la siguen, por tanto, la proporción de masas entre los elementos que los forman es constante. En términos más modernos de la fórmula molecular, esta ley implica que siempre se van a poder asignar subíndices fijos a cada compuesto. Hay que notar que existe una clase de compuestos, denominados compuestos no estequiométricos (también llamados bertólidos), que no siguen esta ley. Para estos compuestos, la razón entre los elementos pueden variar continuamente entre ciertos límites. Naturalmente, otras sustancias como las aleaciones o los coloides, que no son propiamente compuestos sino mezclas, tampoco siguen esta ley. Se le llama materia a todo aquello que tiene masa y ocupa un lugar en el espacio. En la mayoría de los casos, la materia se puede percibir o medir mediante distintos métodos de química analítica.
LEYES FUNDAMENTALES DE LA QUÍMICA
- Ley de la conservación de la masa (o de Lavoisier).
Esta ley se considera enunciada por LAVOISIER, pues si bien era utilizada como hipótesis de trabajo por los químicos anteriores a él se debe a LAVOISIER su confirmación y generalización. Fue uno de los científicos que más contribuyó al desarrollo de la química moderna. Con sus experimentos, evolucionó el concepto de la combustión trazando un nuevo paradigma sobre el papel del oxígeno en los procesos químicos y dando forma a la aún vigente Ley de conservación de la masa que nos dice que:
· La masa de un sistema permanece invariable cualquiera que sea la transformación que ocurra dentro de él; esto es, en términos químicos,la masa de los cuerpos reaccionantes es igual a la masa de los productos de la reacción.
· "En toda reacción química, la masa se conserva, esto es, la masa total de los reactivos es igual a la masa total de los productos". En otras palabras, la materia no se crea ni se destruye durante un proceso químico sino que sólo se reorganiza.
2.Ley de las proporciones definidas (o de Proust).
Estos delicados análisis fueron realizados sobre todo por el químico sueco BERZELIUS (1779 - 1848). No obstante, será el francés PROUST, en 1801, quien generalice el resultado enunciando la ley a la que da nombreLa ley de las proporciones definidas que es:
Cuando dos o más elementos se combinan para formar un determinado compuesto lo hacen en una relación en peso constante independientemente del proceso seguido para formarlo.
Esta ley también se puede enunciar desde otro punto de vista
Para cualquier muestra pura de un determinado compuesto los elementos que lo conforman mantienen una proporción fija en peso, es decir, una proporción ponderal constante.
Así, por ejemplo, en el agua los gramos de hidrógeno y los gramos de oxígeno están siempre en la proporción 1/8, independientemente del origen del agua.
La ley de las proporciones definidas no fue inmediatamente aceptada al ser combatida por BERTHOLLET, el cual, al establecer que algunas reacciones químicas son limitadas, defendió la idea de que la composición de los compuestos era variable. Después, de numerosos experimentos pudo reconocerse en 1807 la exactitud de la ley de Proust. No obstante, ciertos compuestos sólidos muestran una ligera variación en su composición, por lo que reciben el nombre de «berthóllidos». Los compuestos de composición fija y definida reciben el nombre de «daltónidos» en honor de DALTON.
3. Ley de las proporciones múltiples (o de Dalton).
La ley de las proporciones múltiples fue enunciada por John Dalton, en el año 1803, y es una importante ley estequiométrica. Fue demostrada en la práctica por el químico francés Gay-Lussac.
Esta ley indica que cuando dos elementos A y B, son capaces de combinarse entre sí para formar varios compuestos distintos, las distintas masas de B que se unen a una cierta masa de A, están en relación de números enteros y sencillos.
Esta ley ponderal, fue la última en enunciarse. Dalton observó y estudió un fenómeno del que Proust (el químico que enunció la ley de las proporciones constantes) no se había percatado, y es que algunos elementos se combinan entre sí en distintas proporciones para originar compuestos distintos, debido a lo que hoy se conoce como los diferentes estados de oxidación de un elemento, que es lo que le permite combinarse en diferentes proporciones con otro elemento. Lo que Dalton observó es que estas diferentes proporciones guardan una relación entre sí.
4. Ley de las proporciones recíprocas (0 de Richter).
Los pesos de diferentes elementos que se combinan con un mismo peso de un elemento dado, dan la relación de pesos de estos Elementos cuando se combinan entre sí o bien múltiplos o submúltiplos de estos pesos.
Así, por ejemplo, con 1g de oxígeno se unen: 0,1260 g de hidrógeno, para formar agua; 4,4321 g de cloro, para formar anhídrido hipocloroso; 0,3753 g de carbono para formar gas carbónico, 1,0021 g de azufre, para formar gas sulfuroso, y 2,5050 g de calcio, para formar óxido cálcico. Pero los elementos hidrógeno, cloro, carbono, azufre y calcio pueden a su vez combinarse mutuamente y cuando lo hacen se encuentra, sorprendentemente, que estas cantidades, multiplicadas en algún caso por números enteros sencillos, son las que se unen entre sí para formar los correspondientes compuestos.
Esta ley llamada también de las proporciones equivalentes fue esbozada por RICHTER en 1792 y completada varios años más tarde por WENZEL.
La ley de las proporciones recíprocas conduce a fijar a cada elemento un peso relativo de combinación, que es el peso del mismo que se une con un peso determinado del elemento que se toma como tipo de referencia.
El peso equivalente de un elemento (o compuesto) es la cantidad del mismo que se combina o reemplaza -equivale químicamente - a 8,000 partes de oxígeno o 1,008 partes de hidrógeno. Se denomina tambiénequivalente químico.
Debido a la ley de las proporciones múltiples algunos elementos tienen varios equivalentes.
Pesos de combinación de Richter.
Bases
|
Ácidos
| ||||
Nombre de la sustancia
|
Fórmula química
|
Peso equivalente
|
Nombre de la sustancia
|
Fórmula química
|
Peso equivalente
|
Alúmina
|
Al2O3
|
525
|
Fluorhídrico
|
HF
|
427
|
NH3
|
672
|
Carbónico
|
H2 CO3
|
577
| |
Ca O
|
793
|
Muriático
|
HNO3
|
712
| |
Sosa
|
NaOH
|
859
|
Oxálico
|
H2 C2 O4
|
755
|
Potasa
|
KOH 3
|
1605
|
Sulfúrico
|
H2 S O4
|
1000
|
Barita
|
Ba O
|
2222
|
Nítrico
|
H2 N O3
|
1404
|
5.Ley de los volúmenes de combinación (0 de Gay- lussac).
Muchos de los elementos y compuestos son gaseosos, y puesto que es más sencillo medir un volumen que un peso de gas era natural se estudiasen las relaciones de volumen en que los gases se combinan.
En cualquier reacción química los volúmenes de todas las substancias gaseosas que intervienen en la misma, medidos en las mismas condiciones de presión y temperatura, están en una relación de números enteros sencillos.
GAY-LUSSAC formuló en 1808 la ley de los volúmenes de combinación que lleva su nombre. Al obtener vapor de agua a partir de los elementos (sustancias elementales) se había encontrado que un volumen de oxígeno se une con dos volúmenes de hidrógeno formándose dos volúmenes de vapor de agua; todos los volúmenes gaseosos medidos en las mismas condiciones de presión y temperatura.
Esta relación sencilla entre los volúmenes de estos cuerpos gaseosos reaccionantes no era un caso fortuito pues GAY-LUSSAC mostró que se cumplía en todas las reacciones en que intervienen gases tal como muestran los esquemas siguientes:
GAY-LUSSAC observó que el volumen de la combinación gaseosa resultante era inferior o a lo más igual a la suma de los volúmenes de las substancias gaseosas que se combinan.
La ley no se aplica a la relación entre los volúmenes de los cuerpos sólidos y líquidos reaccionantes tal como el volumen de azufre que se une con el oxígeno para formar anhídrido sulfuroso.
APLICACIONES DE LAS LEYES FUNDAMENTALES DE LA QUÍMICA
1ª.- LEY DE LA CONSERVACIÓN DE LA MASA (Lavoisier, 1787)
La suma de las masas de los productos reaccionantes es igual a la suma de las masas de los productos de la reacción.
Es decir, la masa se conserva , lo que nos permite afirmar que si, por ejemplo, 1 g de hidrógeno reacciona con 8 g de oxígeno, para formar agua , la masa de agua formada es de 9 g.
(Esta ley es la base de los cálculos estequiométricos de las reacciones químicas)
2ª.- LEY DE LAS PROPORCIONES DEFINIDAS o CONSTANTES
(Proust, 1799)
Cuando dos o más elementos (o sustancias), se unen para formar una sustancia determinada, lo hacen siempre en proporciones fijas y determinadas.
Por ejemplo, el hidrógeno y el oxígeno cuando se unen para formar agua, siempre reaccionan en la proporción de 1 g de hidrógeno con 8 g de oxígeno (o 2 g de hidrógeno con 16 de oxígeno; o 0,5 g de hidrógeno con 4 de oxígeno). Esta proporción no depende de la forma en que tenga lugar la reacción.
3ª.- LEY DE LAS PROPORCIONES RECÍPROCAS o DE LOS PESOS DE COMBINACIÓN (Richter, 1792).
Las masas de elementos diferentes, que se combinan con una misma masa de otro elemento, son las mismas son las mismas con las que se combinarían entre sí, si la reacción es posible, o son sus múltiplos o sus submúltiplos.
Por ejemplo, 1 g de oxígeno se combina con: 0,12 g de hidrógeno o con 2,50 g de calcio, o con 0,37 g de carbono, o con 4,43 g de cloro. Estas cantidades son las mismas con las que estos elementos se combinan entre sí cuando forman compuestos, es decir, cuando el hidrógeno y el calcio se combinan , lo harán en la proporción de 0,12 g de hidrógeno con 2,50 g de calcio; y cuando lo hagan el cloro y el calcio lo harán en la proporción de 4,43 g de cloro con 2,50 g de calcio.
4ª.- LEY DE LAS PROPORCIONES MÚLTIPLES (Dalton, 1803).
Las cantidades de un mismo elemento que se combinan con una cantidad fija de otro, para formar varios compuestos, están en la relación de los números enteros y sencillos.
Por ejemplo: 1 g de oxígeno reacciona con 3,971 g de cobre para formar un óxido de cobre. Pero cambiando las condiciones de la reacción 1 g de cobre reacciona con 7,942 g de cobre. (No hay fallo de la ley de las proporciones definidas, puesto que se obtienen compuestos distintos). Dividamos las cantidades de cobre entre sí 7,942/3,971 = 2, es decir, están en la proporción 2:1 (números enteros y sencillos).
5ª.- LEY DE LOS VOLÚMENES DE COMBINACIÓN (Gay-Lussac, 1808).
Los volúmenes, medidos en las mismas condiciones de presión y temperatura, de las sustancias gaseosas que intervienen en una reacción química, están en una relación de números enteros y sencillos.
Por ejemplo:
1 litro de oxígeno reacciona con 2 litros de hidrógeno para obtener 2 litros de vapor de agua.
1 litro de nitrógeno reacciona con 3 litros de hidrógeno, obteniéndose 2 litros de amoníaco.
Esta ley solamente se puede aplicar a las reacciones entre sustancias en estado gaseoso.
6ª.- LEY DE AVOGADRO (1811).
A igualdad de presión y temperatura, volúmenes iguales de sustancias gaseosas con tiene el mismo número de moléculas.
Es decir, que en un litro de hidrógeno y en un litro de oxígeno, si se encuentran a la misma presión y temperatura, hay el mismo número de moléculas.
La suma de las masas de los productos reaccionantes es igual a la suma de las masas de los productos de la reacción.
Es decir, la masa se conserva , lo que nos permite afirmar que si, por ejemplo, 1 g de hidrógeno reacciona con 8 g de oxígeno, para formar agua , la masa de agua formada es de 9 g.
(Esta ley es la base de los cálculos estequiométricos de las reacciones químicas)
2ª.- LEY DE LAS PROPORCIONES DEFINIDAS o CONSTANTES
(Proust, 1799)
Cuando dos o más elementos (o sustancias), se unen para formar una sustancia determinada, lo hacen siempre en proporciones fijas y determinadas.
Por ejemplo, el hidrógeno y el oxígeno cuando se unen para formar agua, siempre reaccionan en la proporción de 1 g de hidrógeno con 8 g de oxígeno (o 2 g de hidrógeno con 16 de oxígeno; o 0,5 g de hidrógeno con 4 de oxígeno). Esta proporción no depende de la forma en que tenga lugar la reacción.
3ª.- LEY DE LAS PROPORCIONES RECÍPROCAS o DE LOS PESOS DE COMBINACIÓN (Richter, 1792).
Las masas de elementos diferentes, que se combinan con una misma masa de otro elemento, son las mismas son las mismas con las que se combinarían entre sí, si la reacción es posible, o son sus múltiplos o sus submúltiplos.
Por ejemplo, 1 g de oxígeno se combina con: 0,12 g de hidrógeno o con 2,50 g de calcio, o con 0,37 g de carbono, o con 4,43 g de cloro. Estas cantidades son las mismas con las que estos elementos se combinan entre sí cuando forman compuestos, es decir, cuando el hidrógeno y el calcio se combinan , lo harán en la proporción de 0,12 g de hidrógeno con 2,50 g de calcio; y cuando lo hagan el cloro y el calcio lo harán en la proporción de 4,43 g de cloro con 2,50 g de calcio.
4ª.- LEY DE LAS PROPORCIONES MÚLTIPLES (Dalton, 1803).
Las cantidades de un mismo elemento que se combinan con una cantidad fija de otro, para formar varios compuestos, están en la relación de los números enteros y sencillos.
Por ejemplo: 1 g de oxígeno reacciona con 3,971 g de cobre para formar un óxido de cobre. Pero cambiando las condiciones de la reacción 1 g de cobre reacciona con 7,942 g de cobre. (No hay fallo de la ley de las proporciones definidas, puesto que se obtienen compuestos distintos). Dividamos las cantidades de cobre entre sí 7,942/3,971 = 2, es decir, están en la proporción 2:1 (números enteros y sencillos).
5ª.- LEY DE LOS VOLÚMENES DE COMBINACIÓN (Gay-Lussac, 1808).
Los volúmenes, medidos en las mismas condiciones de presión y temperatura, de las sustancias gaseosas que intervienen en una reacción química, están en una relación de números enteros y sencillos.
Por ejemplo:
1 litro de oxígeno reacciona con 2 litros de hidrógeno para obtener 2 litros de vapor de agua.
1 litro de nitrógeno reacciona con 3 litros de hidrógeno, obteniéndose 2 litros de amoníaco.
Esta ley solamente se puede aplicar a las reacciones entre sustancias en estado gaseoso.
6ª.- LEY DE AVOGADRO (1811).
A igualdad de presión y temperatura, volúmenes iguales de sustancias gaseosas con tiene el mismo número de moléculas.
Es decir, que en un litro de hidrógeno y en un litro de oxígeno, si se encuentran a la misma presión y temperatura, hay el mismo número de moléculas.
CONSTANTE DE AVOGADRO
La constante de Avogadro (símbolos: L, NA) es el número de partículas elementales (usualmente átomos o moléculas) en un mol de una sustancia cualquiera, donde el mol es una de las sieteunidades básicas del Sistema Internacional de Unidades (SI). Su dimensión es el recíproco del mol y su valor es igual a 6,022 40857(74) ×1023 mol−1.2 3 4
Definiciones anteriores de cantidad química involucraron el número de Avogadro, un término histórico íntimamente relacionado a la constante de Avogadro pero definida de otra forma: inicialmente definido por Jean Baptiste Perrin como el número de átomos en un mol de hidrógeno. Luego fue redefinido como el número de átomos en 12 gramos del isótopo carbono-12 y posteriormente generalizado para relacionar cantidades de sustancias a sus pesos moleculares.5 Por ejemplo, de forma aproximada, 1 gramo de hidrógeno, que tiene un número másico de 1, contiene 6,022 × 1023átomos de hidrógeno, es decir más de seiscientos mil trillones de átomos. De igual manera, 12 gramos de carbono-12 (número másico de 12) contiene el mismo número de átomos, 6,022 × 1023. El número de Avogadro es una magnitud adimensional y tiene el valor numérico de la constante de Avogadro, que posee unidades de medida.
La constante de Avogadro es fundamental para entender la composición de las moléculas y sus interacciones y combinaciones. Por ejemplo, ya que un átomo de oxígeno se combinará con dos átomos de hidrógeno para crear una molécula de agua (H2O), de igual forma un mol de oxígeno (6,022 × 1023 átomos de O) se combinarán con dos moles de hidrógeno (2 × 6,022 × 1023 átomos de H) para crear un mol de H2O.
Revisiones en el conjunto de las unidades básicas del SI hicieron necesario una redefinición de los conceptos de cantidad química, por lo que el número de Avogadro y su definición fueron reemplazados por la constante de Avogadro y su definición. Se ha propuesto que cambios en las unidades SI fijará de manera precisa el valor de la constante a exactamente 6,02214X×1023 al expresarla en la unidad mol−1 (véase Redefinición de las unidades del SI, la X al final de un número significa que uno o más dígitos finales poseen cierta incertidumbre).
Debido a su papel como factor de escala, la constante de Avogadro establece un vínculo entre una serie de útiles constantes físicas cuando nos movemos entre la escala atómica y la escala macroscópica. Por ejemplo, establece la relación entre:
la constante de los gases R y la constante de Boltzmann kB (en J mol−1 K−1):

la constante de Faraday F y la carga elemental e (en C mol−1):

La constante de Avogadro también entra en la definición de la constante de masa atómica (mu):

donde Mu es la constante de masa molar
DETERMINACIONES DE MASAS MOLECULARES RELATIVAS
| ||||||||||||||||||||||||||||||||||||||||||||||||
La interpretación de los datos volumétricos a la luz de la hipótesis de Avogadro permitió obtener fórmulas correctas de muchos elementos y compuestos, evitando la regla de máxima simplicidad. Adicionalmente, la combinación de estos conocimientos con los resultados del análisis químico también sirvió para obtener masas atómicas y masas moleculares relativas.
| ||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
De los datos de la reacción anterior también se deduce la obviedad de que la molécula de hidrógeno gaseoso (H2) tiene una masa doble que la del átomo de hidrógeno y que la molécula de cloruro de hidrógeno (HCl) debería tener una masa 36.5 (35.5 + 1) veces mayor que la del átomo de hidrógeno.
| ||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
Sobre la base de estos hallazgos y hasta mediados del siglo XX, los químicos y físicos utilizaron dos escalas de masa atómicas relativas. Los químicos usaban una escala tal que la mezcla natural de isótopos de oxígeno tenía una masa atómica de 16, mientras que los físicos asignaron el mismo número 16 a la masa atómica del isótopo de oxígeno más común (oxígeno-16). Como en el oxígeno natural están presentes el oxígeno-17 y el oxígeno-18, esto conducía a 2 tablas diferentes de masas atómicas relativas.
| ||||||||||||||||||||||||||||||||||||||||||||||||
Entre 1959 y 1960 ambas organizaciones acordaron una escala unificada, basada en el carbono-12 (el carbono-12 es el más abundante de los dos isótopos estables del elemento carbono, representando el 98,89% de todo el carbono terrestre). Esta escala cumplía el requerimiento de los físicos de basar la escala en un isótopo puro y a la vez se hacía numéricamente cercana a la escala de los químicos. Atendiendo a esta escala unificada se define:
| ||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
La unidad de masa atómica relativa y de masa molecular relativa se llama Dalton o unidad de masa atómica y se abrevia u (antes uma).
- DETERMINACIÓN DE MASAS MOLECULAR RELATIVA
Teoría de Avogadro[editar]
No fue hasta 1814 cuando Avogadro admitió la existencia de moléculas gaseosas formadas por dos o más átomos iguales. Según Avogadro, en una reacción química una molécula de reactivo debe reaccionar con una o varias moléculas de otro reactivo, dando lugar a una o varias moléculas del producto, pero una molécula no puede reaccionar con un número no entero de moléculas, ya que la unidad mínima de un reactivo es la molécula. Debe existir, por tanto, una relación de números enteros sencillos entre las moléculas de los reactivos, y entre estas moléculas y las del producto.
Según la Ley de los volúmenes de combinación esta misma relación es la que ocurre entre los volúmenes de los gases en una reacción química. Por ello, debe de existir una relación directa entre estos volúmenes de gases y el número de moléculas que contienen.
La ley de Avogadro dice que:
También el enunciado inverso es cierto: "Un determinado número de moléculas de dos gases diferentes ocupan el mismo volumen en idénticas condiciones de presión y temperatura".
Esta ley suele enunciarse actualmente también como: "Un mol de diferentes sustancias contiene el mismo número de moléculas".
El valor de este número, llamado número de Avogadro es aproximadamente 6,022 × 1023 y es también el número de átomos que contiene un mol de un elemento.
Para explicar esta ley, Avogadro señaló que las moléculas de la mayoría de los gases elementales más habituales eran diatómicas (hidrógeno, cloro, oxígeno, nitrógeno, etc), es decir, que mediante reacciones químicas se pueden separar en dos átomos.
La ley de Avogadro no fue admitida inicialmente por la comunidad científica. No lo fue hasta que en 1860 Cannizzaro presentó en el primer Congreso Internacional de Química, el Congreso de Karlsruhe, un artículo (publicado en 1858) sobre la hipótesis de Avogadro y la determinación de pesos atómicos.
Con estas suposiciones, la justificación de la ley de los volúmenes de combinación de Gay-Lussac es bastante como se muestra en los siguientes ejemplos.
Síntesis del cloruro de hidrógeno[editar]
Experimentalmente se comprueba que un volumen de dihidrógeno reacciona con un volumen de dicloro para dar dos volúmenes de cloruro de hidrógeno.
Según lo establecido en la ley de Avogadro, a temperatura y presión constantes en cada volumen unidad (de dihidrógeno y de dicloro) habrá un mismo y determinado número de moléculas "N".
Como las moléculas de dihidrógeno y dicloro son diatómicas, la reacción química de síntesis del cloruro de hidrógeno consistiría en la rotura de las moléculas de dihidrógeno y dicloro y su posterior reorganización para dar doce moléculas de cloruro de hidrógeno (una por cada átomo de cloro e hidrógeno). Como se ha supuesto que en un volumen de gas hay seis moléculas, doce moléculas corresponden a un volumen dos veces mayor.
Los volúmenes de los gases reaccionantes están en la relación 1:1, mientras que el de cloruro de hidrógeno respecto al de dihidrógeno o al de dicloro está en la relación 2:1, tal como se establece la ley de Gay-Lussac.
Síntesis del agua[editar]
Si los gases fueran monoatómicos cada dos volúmenes de hidrógeno y uno de oxígeno debería obtenerse un volumen de agua. Experimentalmente se comprueba que dos volúmenes de dihidrógeno reaccionan con un volumen de dioxígeno para dar dos volúmenes de agua.
De acuerdo con la ley de Avogadro, la reacción de síntesis del agua necesitaría que cada dos moléculas de dihidrógeno reaccionaran con una molécula de dioxígeno para obtener dos moléculas de agua. La molécula de dioxígeno tiene que estar formada al menos por dos átomos, para que por lo menos uno de ellos entre a formar parte de cada molécula de agua. Si se supone que en un volumen de gas hay seis moléculas, se tiene como reactivos 12 moléculas de dihidrógeno (formadas por 24 átomos de hidrógeno en total) y 6 moléculas de dioxígeno (formadas por 12 átomos de oxígeno en total). Si se obtienen dos volúmenes de agua (12 moléculas), cada molécula de agua debe tener de fórmula H2O.
Síntesis del amoníaco[editar]
Experimentalmente se comprueba que tres volúmenes de dihidrógeno reaccionan con un volumen de dinitrógeno para dar dos volúmenes de amoníaco.
Esta reacción de síntesis del amoníaco precisa que cada cinco moléculas de hidrógeno reaccionen con una molécula de nitrógeno dando lugar a dos moléculas de amoníaco. La molécula de dinitrógeno tiene que estar formada al menos por dos átomos, para que por lo menos uno de ellos entre a formar parte de cada molécula de amoníaco. Si se supone que en un volumen de gas hay seis moléculas, tenemos como reactivos 18 moléculas de dihidrógeno (formadas por 36 átomos de hidrógeno en total) y 6 moléculas de dinitrógeno (formadas por 12 átomos de nitrógeno). Si se obtienen dos volúmenes de amoníaco (12 moléculas), cada molécula debe tener de fórmula NH3.
|
Isótopos y sus aplicaciones
Todos los átomos de un elemento químico tienen el mismo número de protones, pero pueden diferenciarse en el número de neutrones.
Se llaman Isótopos los átomos que tienen el mismo número de protones y se diferencian en el número de neutrones. Por tanto, presentan el mismo número atómico (Z) y diferente número másico (A).
Los isótopos tienen masa diferente, ya que tienen distinto número de neutrones.
Para nombrarlos se indica su nombre seguido de su número másico; por ejemplo, sodio-23 (Na-23).
Aquí te presentamos algunos Isótopos y sus aplicaciones
- Deuterio 2H: se usa como rastreador para estudiar reacciones químicas o rutas metabólicas (ya que puede sustituir un hidrógeno y puedes seguirlo para ver “a donde va” esa molécula o “que va a hacer”), en resonancia magnética (para estudiar estructuras moleculares) o para una hipotética fusión fría (imitando las reacciones que se producen en el Sol) que parece inviable de conseguir hoy en día por grandes dificultades tecnológicas.
Otra aplicación interesante es el estudio de la temperatura de la Tierra a lo largo de toda su historia midiendo la cantidad de deuterio que ha quedado atrapado en el hielo de la Antártida.
- Tritio 3H: El tritio tiene aplicaciones médicas como rastreador ya que al descomponerse, como hemos visto, emite electrones de baja energía pero no rayos γ (que es un tipo de radiación mucho más peligrosa) .La bomba de hidrógeno es en realidad bomba de tritio.
- El carbono-13 13C: Los compuestos enriquecidos de 13C se usan en estudios de procesos metabólicos por medio de la espectrometría de masas.
- El carbono-14 14C: El método de datación por radiocarbono es la técnica basada en isótopos más fiable para conocer la edad de muestras orgánicas de menos de 60.000 años.
- 99Tc: Puede usarse para identificar vasos sanguíneos bloqueados.
- Oro-198 198Au: Se aplica en inyecciones, para zonas cancerosas.
- Radioyodo I-131: Se usa como un tratamiento para la excesiva actividad de la glándula tiroides, una afección denominada hipertiroidismo. Cuando se ingiere una pequeña dosis de I-131, se absorbe hacia el flujo sanguíneo en el tracto gastrointestinal (GI) y se concentra en la sangre por la glándula tiroides, donde comienza a destruir las células de la glándula.
- El Cobalto-60 (60Co): Se usa como elemento traza de cobalto en reacciones químicas, esterilización de equipo médico, fuente de radiación para radioterapia médica para el cáncer, fuente de radiación para radiografía industrial, fuente de energía.
CONSTANTE DE AVOGADRO
La constante de Avogadro (símbolos: L, NA) es el número de partículas elementales (usualmente átomos o moléculas) en un mol de una sustancia cualquiera, donde el mol es una de las sieteunidades básicas del Sistema Internacional de Unidades (SI). Su dimensión es el recíproco del mol y su valor es igual a 6,022 40857(74) ×1023 mol−1.2 3 4
Definiciones anteriores de cantidad química involucraron el número de Avogadro, un término histórico íntimamente relacionado a la constante de Avogadro pero definida de otra forma: inicialmente definido por Jean Baptiste Perrin como el número de átomos en un mol de hidrógeno. Luego fue redefinido como el número de átomos en 12 gramos del isótopo carbono-12 y posteriormente generalizado para relacionar cantidades de sustancias a sus pesos moleculares.5 Por ejemplo, de forma aproximada, 1 gramo de hidrógeno, que tiene un número másico de 1, contiene 6,022 × 1023átomos de hidrógeno, es decir más de seiscientos mil trillones de átomos. De igual manera, 12 gramos de carbono-12 (número másico de 12) contiene el mismo número de átomos, 6,022 × 1023. El número de Avogadro es una magnitud adimensional y tiene el valor numérico de la constante de Avogadro, que posee unidades de medida.
La constante de Avogadro es fundamental para entender la composición de las moléculas y sus interacciones y combinaciones. Por ejemplo, ya que un átomo de oxígeno se combinará con dos átomos de hidrógeno para crear una molécula de agua (H2O), de igual forma un mol de oxígeno (6,022 × 1023 átomos de O) se combinarán con dos moles de hidrógeno (2 × 6,022 × 1023 átomos de H) para crear un mol de H2O.
Revisiones en el conjunto de las unidades básicas del SI hicieron necesario una redefinición de los conceptos de cantidad química, por lo que el número de Avogadro y su definición fueron reemplazados por la constante de Avogadro y su definición. Se ha propuesto que cambios en las unidades SI fijará de manera precisa el valor de la constante a exactamente 6,02214X×1023 al expresarla en la unidad mol−1 (véase Redefinición de las unidades del SI, la X al final de un número significa que uno o más dígitos finales poseen cierta incertidumbre).
La carga eléctrica es una propiedad física intrínseca de algunas partículas subatómicas que se manifiesta mediante fuerzas de atracción y repulsión entre ellas por la mediación de campos electromagnéticos. La materia cargada eléctricamente es influida por los campos electromagnéticos, siendo a su vez, generadora de ellos. La denominada interacción electromagnética entre carga y campo eléctrico es una de las cuatro interacciones fundamentales de la física. Desde el punto de vista del modelo estándar la carga eléctrica es una medida de la capacidad que posee una partícula para intercambiar fotones.
Una de las principales características de la carga eléctrica es que, en cualquier proceso físico, la carga total de un sistema aislado siempre se conserva. Es decir, la suma algebraica de las cargas positivas y negativas no varía en el tiempo.
La carga eléctrica es de naturaleza discreta, fenómeno demostrado experimentalmente por Robert Millikan. Por razones históricas, a los electrones se les asignó carga negativa: –1, también expresada –e. Los protones tienen carga positiva: +1 o +e. A los quarks se les asigna carga fraccionaria: ±1/3 o ±2/3, aunque no se los ha podido observar libres en la naturaleza.1
Carga eléctrica elemental[editar]
Las investigaciones actuales de la física apuntan a que la carga eléctrica es una propiedad cuantizada. La unidad más elemental de carga se encontró que es la carga que tiene el electrón, es decir alrededor de 1,602 176 487(40) × 10-19 culombios (C) y es conocida como carga elemental.5 El valor de la carga eléctrica de un cuerpo, representada como q o Q, se mide según el número de electrones que posea en exceso o en defecto.6
Esta propiedad se conoce como cuantización de la carga y el valor fundamental corresponde al valor de carga eléctrica que posee el electrón y al cual se lo representa como e. Cualquier carga q que exista físicamente, puede escribirse como 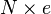 siendo N un número entero, positivo o negativo.
siendo N un número entero, positivo o negativo.
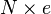 siendo N un número entero, positivo o negativo.
siendo N un número entero, positivo o negativo.
Por convención se representa a la carga del electrón como -e, para el protón +e y para el neutrón, 0. La física de partículas postula que la carga de los quarks, partículas que componen a protones y neutrones toman valores fraccionarios de esta carga elemental. Sin embargo, nunca se han observado quarks libres y el valor de su carga en conjunto, en el caso del protón suma +e y en el neutrón suma 0.7
Aunque no tenemos una explicación suficientemente completa de porqué la carga es una magnitud cuantizada, que sólo puede aparecer en múltiplos de la carga elemental, se han propuestos diversas ideas:
- Paul Dirac mostró que si existe un monopolo magnético la carga eléctrica debe estar cuantizada.
- En el contexto de la teoría de Kaluza-Klein, Oskar Klein encontró que si se interpretaba el campo electromagnético como un efecto secundario de la curvatura de un espacio tiempo de topología
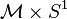 , entonces la compacidad de
, entonces la compacidad de 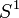 comportaría que el momento lineal según la quinta dimensión estaría cuantizado y de ahí se seguía la cuantización de la carga.
comportaría que el momento lineal según la quinta dimensión estaría cuantizado y de ahí se seguía la cuantización de la carga.
En el Sistema Internacional de Unidades la unidad de carga eléctrica se denomina culombio (símbolo C) y se define como la cantidad de carga que a la distancia de 1 metro ejerce sobre otra cantidad de carga igual, la fuerza de 9×109 N.
Un culombio corresponde a la carga de 6,241 509 × 1018 electrones.8 El valor de la carga del electrón fue determinado entre 1910 y 1917 por Robert Andrews Millikan y en la actualidad su valor en el Sistema Internacional de acuerdo con la última lista de constantes del CODATA publicada es:5
Como el culombio puede no ser manejable en algunas aplicaciones, por ser demasiado grande, se utilizan también sus submúltiplos:
- 1 miliculombio =
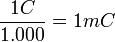
- 1 microculombio =
Frecuentemente se usa también el sistema CGS cuya unidad de carga eléctrica es el Franklin (Fr). El valor de la carga elemental es entonces de aproximadamente 4,803×10–10 Fr.
La cristalografía de rayos X es una técnica experimental para el estudio y análisis de materiales, basada en el fenómeno de difracción de los rayos X por sólidos en estado cristalino.
Los rayos X son difractados por los electrones que rodean los átomos por ser su longitud de onda del mismo orden de magnitud que el radio atómico. El haz de rayos X emergente tras esta interacción contiene información sobre la posición y tipo de átomos encontrados en su camino. Los cristales, gracias a su estructura periódica, dispersan elásticamente los haces de rayos X en ciertas direcciones y los amplifican por interferencia constructiva, originando un patrón de difracción.n. 1 Existen varios tipos de detectores especiales para observar y medir la intensidad y posición de los rayos X difractados, y su análisis posterior por medios matemáticos permite obtener una representación a escala atómica de los átomos y moléculas del material estudiado.
Max von Laue realizó los primeros experimentos de cristalografía de rayos X en 1912. Von Laue, William Henry Bragg y William Lawrence Bragg desarrollaron inicialmente la teoría de difracción de cristales, tarea a la que pronto se sumaron otros científicos. A lo largo del siglo XX tuvieron lugar varios avances teóricos y técnicos, como la aparición de los superordenadores y el uso desincrotrones para la producción de rayos X, que incrementaron la capacidad del método para determinar las propiedades estructurales de todo tipo de moléculas: sales, materiales inorgánicos complejos, proteínas y hasta componentes celulares como los ribosomas. Es posible trabajar con monocristales o con polvo microcristalino, consiguiéndose diferentes datos en ambos casos: para las aplicaciones que requieren solo una caracterización precisa de los parámetros de la red cristalina, puede ser suficiente la difracción de rayos X por polvo; para una dilucidación precisa de las posiciones atómicas es preferible trabajar con monocristales.
Dada la relación existente entre la estructura tridimensional de las moléculas y sus propiedades químicas y físicas, la cristalografía ha contribuido al avance en varias disciplinas científicas como laquímica, la biología molecular, la geología, la física aplicada y la ciencia de materiales. La amplia disponibilidad de tubos de rayos X, complementada con el desarrollo de fuentes de rayos X de alta intensidad ha aumentado significativamente su impacto en estos campos de investigación así como en áreas con aplicaciones industriales, como el desarrollo de fármacos y la mineralogía aplicada. La mayor limitación de este método es la necesidad de trabajar con sistemas cristalinos, por lo que no es aplicable a disoluciones, a sistemas biológicos in vivo, a sistemas amorfos o agases. En algunos casos, los rayos X pueden romper los enlaces químicos que mantienen la integridad estructural, lo que resulta en un modelo distorsionado de la molécula estudiada. Este problema afecta especialmente a los materiales de interés biológico.
Añadir gadget lista de enlaces.Título: Blogs del grupo 6'D'Nombre del sitio y URL. Añadir enlace.Juan Jesús y Fernado: almno-d-lerning.blogspot.mxKaren Arely y Wendy: loquillas123.blogspot.mxPedro Valente y Luis Fernando: porquetengoquehaceresto6d.blogspot.mxIridian y Elisa: panesitoooo.blogspot.mxRicardo y Juan Fernando: nuestronuevoblogfr.blogspot.mxViridiana y Alondra: universo160.blogspot.mxFabián y Gerardo Alfredo: gerardo-fabian.blogspot.mxGabriela y Jorge Leonardo: legamega.blogspot.mxJulio Israel y Marco Eduardo: equipo7cetis160.blogspot.mxMaría José y Juan Carlos: 6dmyj.blogspot.mxRosa Isela y Juan Alberto: juanandrosy.blogspot.mxRosa María: papichulitooooo.blogspot.mxEduardo y Felipe: equipo6d.blogspot.mx
Añadir gadget lista de enlaces.Título: Blogs del grupo 6'D'Nombre del sitio y URL. Añadir enlace.Juan Jesús y Fernado: almno-d-lerning.blogspot.mxKaren Arely y Wendy: loquillas123.blogspot.mxPedro Valente y Luis Fernando: porquetengoquehaceresto6d.blogspot.mxIridian y Elisa: panesitoooo.blogspot.mxRicardo y Juan Fernando: nuestronuevoblogfr.blogspot.mxViridiana y Alondra: universo160.blogspot.mxFabián y Gerardo Alfredo: gerardo-fabian.blogspot.mxGabriela y Jorge Leonardo: legamega.blogspot.mxJulio Israel y Marco Eduardo: equipo7cetis160.blogspot.mxMaría José y Juan Carlos: 6dmyj.blogspot.mxRosa Isela y Juan Alberto: juanandrosy.blogspot.mxRosa María: papichulitooooo.blogspot.mxEduardo y Felipe: equipo6d.blogspot.mx












Bibiana: Hace falta que el texto este del mismo tamaño, justificado y hace falta acomodar unas imagenes
ResponderBorrarMi calificacion 8
YASBETH PALOMARES RUIZ
ResponderBorrarACOMODA LAS LETRAS DEL MISMO TAMAÑO,NO ES ENTENDIBLE
CALIFICACION 8
Dulce Molina
ResponderBorrarLas letras estan de diferente tamaño y las mas pequeñitas no se alcanza a leer muy bien.
calif. 7
LUIS FERNANDO GARCIA
ResponderBorrarEL TAMAÑO DE LAS LETRAS ES MUY DISCORDANTE, AJUSTA EL TEXTO Y HACE FALTA INFORMACIÓN.
CALIFICACIÓN: 7
Saul Gonzalez Rojas
ResponderBorrarTrata de acomodar la letra, que este un poco mas grande en algunos casos y justificada.
CAlificacion: 7.5
Alba Monserrat Rodriguez Mojica
ResponderBorraracomoda la letra a un solo tamaño
Calificacion: 7
Luis Martin Escamilla Tapia
ResponderBorrarLa informacion es buena,solo que hay que acomodar el tamaño de la letra.
Calificacion: 7
RAUL VALADEZ GONZALEZ
ResponderBorrarFALTA JUSTIFICAR TODO EL TEXTO Y AUMENTAR EL TAMAÑO DE LOS TÍTULOS
CALIFICACIÓN 8.5
RAUL VALADEZ GONZALEZ
ResponderBorrarFALTA JUSTIFICAR TODO EL TEXTO Y AUMENTAR EL TAMAÑO DE LOS TÍTULOS
CALIFICACIÓN 8.5
Jorge Valdez Teniente
ResponderBorrarAl momento de copiar y pegar trata de quitar los hipervinculos
Calificacion 6.5
JOSE DIDIERE RAMIREZ:
ResponderBorrarEN ALGUNOS TEXTOS LA LETRA ES DEMACIADO PEQUEÑA Y EN OTRAS MUY GRANDE ADEMAS LE FALTAN IMAGENES Y CENTRARLAS TAMBIEN.
CALIFICACION: 7
Leilani Martinez:
ResponderBorrarel texto se tiene que acomodar
le hacen falta imágenes
calificación :7
Alan Francisco Jimenez
ResponderBorrarle falta informacion y cambiar el tamaño de la letra
calificacion 5
.I.
BorrarMaria Isabel Vargas Vargas
ResponderBorrarEsta muy pequeña la letra y te hace falta justificar todo asi como incluir mas informacion e imagenes.
Calificacion: 6
Paulo Omar Lema Cortes
ResponderBorraracomodar la lertra en tipo,tamaño y color quitar hipervinculos justificar y acomodar negritas.
calificacion 6
FATIMA ESPARZA RIOS
ResponderBorrarAL MOMENTO DE COPIAR Y PEGAR TRATA DE QUITAR HIPERVINCULOS,ADEMAS JUSTIFICA TEXTOS, UNIFICA LETRA Y UN POCO MAS GRANDE
CALIFICACION 6
SAIRA MIRANDA
ResponderBorrarFALTA INFORMACIÓN, JUSTIFICA LOS TEXTOS, ELIMINA LOS HIPERVINCULOS Y CENTRA LAS IMÁGENES.
CALIFICACIÓN: 6
SAIRA MIRANDA
ResponderBorrarFALTA INFORMACIÓN, JUSTIFICA LOS TEXTOS, ELIMINA LOS HIPERVINCULOS Y CENTRA LAS IMÁGENES.
CALIFICACIÓN: 6
SAIRA MIRANDA
ResponderBorrarFALTA INFORMACIÓN, JUSTIFICA LOS TEXTOS, ELIMINA LOS HIPERVINCULOS Y CENTRA LAS IMÁGENES.
CALIFICACIÓN: 6
Jose Andrés Medrano Alcalá:
ResponderBorrarEl Blog detalles en los textos como color, tamaño que deben acomodar y centrar imagenes y le falta información
Calificación 6.
Giio: Que acomodes unas imágenes de tamaño y justifiques el texto.
ResponderBorrarCalificación: 7
Juan Angel Vazquez
ResponderBorrarLe falta justicar textos y hacer un poco mas grande la letra Calificacion: 7